Omicron e l’endemizzazione del Covid-19
Articolo del 09 Febbraio 2022
Sembra sempre più chiaro che la nostra capacità di instaurare una convinvenza se non pacifica almeno tollerata con il virus dipenderà esclusivamente da due fattori: da un lato dalle nostre risorse scientifiche (vaccini, farmaci) o tecnologiche (sistemi di sorveglianza, areazione); dall’ altro – e largamente – dal virus stesso, o meglio dalle varianti che seguiranno nei prossimi anni. Noi manteniamo totale padronanza, almeno in principio, sulle prime (scienza e tecnologia) ma abbiamo perso completamente il controllo sulla evoluzione virale che riceviamo molto passivamente. Provo a fare il punto su come il virus si è evoluto in questi due anni per spiegare quanto complicata sia la situazione e quanto difficile sia fare previsioni.
Evoluzione del virus (e dell’ uomo)
Alcuni pensano che sia possibile farsi un’idea di quello che ci aspetta confrontando il SARS-CoV-2 agli altri coronavirus umani noti. Sono almeno sette tipi di coronavirus più studiati: 4 sono i cossiddetti virus del raffreddore (229E, NL63; HKU1; OC43); 2 sono coronavirus apparsi molto recentemente (MERS-Cov e SARS-CoV-1); e infine c’è quello del Covid-19 (SARS-CoV-2). La prima domanda che tutti si pongono quindi è la seguente: “è ragionevole aspettarsi che fra qualche mese, quando tutta la popolazione adulta avrà acquisito un qualche tipo di protezione immunitaria, il SARS-CoV-2 diventi anch’esso un virus del raffreddore?”
La pericolosità di un virus dipende da due fattori. Da un lato dalla biologia intrinseca del virus e dall’ altro dalla risposta immune che incontra lungo la propria strada. La combinazione peggiore di questi due fattori si osserva puntualmente nella prima fase di ogni pandemia quando il numero di individui che non ha mai incontrato il virus (individui naive, per usare il gergo tecnico) è massimo. Successivamente, attraverso le vaccinazioni e attraverso infezioni pregresse il numero di individui naive diminuisce finché la pericolosità dipende largamente (ma non unicamente) dalle caratteristiche intrinsiche del virus.
Raggiunto quel punto, che noi stiamo raggiungendo ora, subentra un nuovo braccio di ferro evolutivo tra le due specie noto in genetica come host-pathogen co-evolution, con un enfasi su quella particella “co-” che indica che sia il patogeno (il virus) che il suo ospite (l’uomo) evolvono in concerto. In linea di massima, il patogeno evolve per diventare più contagioso mentre l’ospite evolve per diventare più resistente. Esempi di questa co-evoluzione ne conosciamo tanti. Uno dei più famosi per motivi storici è quello della co-evoluzione tra uomo e plasmodio della malaria, importante per il nostro paese perché ha letteralmente cambiato il profilo genetico di molti italiani.
Il plasmodio che causa la malaria passa attraverso una fase replicativa e biologica che ne richiede l’interazione con i globuli rossi e quando questi globuli rossi non funzionano perfettamente il plasmodio ne risente e perde parte della propria virulenza. Il meccanismo di questo fenomeno è complicato ed è stato scoperto solo recentemente (Ferreira et al 2011) ma l’interazione dei due fattori è nota da molto tempo, tanto che il nome generico per questa condizione (talassemia) deriva etimologicamente dal greco proprio per indicare che questa malattia era tipica del Mediterraneo (thalassa era il Mar Mediterraneo).

La prevalenza di anemia falciforme è molto più alta laddove la malaria è o è stata endemica. Da Piel et al. NEJM 2017.
Nelle zone palustri malariche, quindi, gli esseri umani hanno paradossalmente un vantaggio ad avere problemi ai globuli rossi, perché in questo modo sono più protetti dalla malattia malarica. Questo spiega perché proprio in quelle zone si accumula una percentuale più alta di talassemici. Questo concetto di co-evoluzione tra patogeno e ospite è fatto risalire formalmente a JBS Haldane, brillante genetista poliedrico britannico universalmente riconosciuto come uno degli scienziati più influenti mai esisistiti. Nel 1949 Haldane scrisse un articolo di opinione dopo un incontro che ebbe allora con un altro gigante della genetica a una conferenza in Italia (Luigi Cavalli Sforza) e postulò in poche righe quello che ora è un intero campo scientifico. Haldane scrisse in quell’opera:
“È più facile per un topo acquisire casualmente mutazioni che conferiscano resistenza al bacillo del tifo che mutazioni che lo proteggano da un gatto.”
A distanza di 70 anni da quel fondamentale lavoro concettuale, abbiamo ora tanti esempi di co-evoluzione di questo tipo, che ci mostrano ad esempio di fattori genetici che proteggono da HIV (accumulatisi in alcune popolazioni europee proprio perché forse proteggevano dalla peste bubbonica!), o esempi materiali di co-evoluzione tra virus e conigli. Questa co-evoluzione tra patogeno e ospite spiega anche perché, nel corso dei secoli e dei millenni, alcuni virus tendono ad apparire più “buoni”: è l’ospite che acquisisce mutazioni che diventano protettive e quindi si diffondono con più “fitness” nella popolazione.1 È un fenomeno che alle elementari si studia non in scienze ma in storia, quando per la prima volta ci insegnano delle malattie che i conquistatori europei portarono, spesso consapevolmente, nelle Americhe a popoli che non erano mai stati selezionati geneticamente per mitigarne la virulenza.
Alla base di questo fattore esiste una delle misconcezioni più comuni di questa pandemia, cioè quella che “tutti i virus diventano più buoni”. Siamo noi che, nei secoli, diventiamo più resistenti e questo del virus che diventa intrinsicamente più buono non è assolutamente un aspetto su cui si debba fare affidamento. Dirò di più: non esiste evidenza che questo sia mai accaduto, soprattutto perché la nostra conoscenza dei virus è molto limitata nel tempo. Ad esempio, possiamo stimare da studi genomici che proprio il coronavirus che ora causa il normale raffreddore risale al primo medioevo ma non abbiamo nessun modo di sapere quale fosse la sintomatologia e la virulenza di quel virus all’epoca in cui emerse. Dall’altro lato, abbiamo evidenza di virus che per decenni o più hanno travagliato i propri ospiti con letalità vicine al 100% senza mai sentire la pressione selettiva di dover cambiare, come la peste suina africana di cui in questi giorni si parla in Italia. Questa misconcezione ha portato i giornali a parlare di “raffreddorizzazione del virus” ma l’attento lettore avrà ora chiaro che il principale argomento a favore di questa presunta “raffredorizzazione” è essenzialmente legato al fatto che il numero di soggetti naive diminuisca grazie alla vaccinazione.
Infatti, soprattutto attraverso le vaccinazioni, la maggior parte della popolazione adulta nei paesi sviluppati ha acquisito una memoria immunitaria verso il Sars-CoV-2. Già sappiamo che questa memoria immunitaria regalataci dai vaccini non è perpetua ma tende a scemare molto velocemente nella protezione da contagio e più lentamente nella protezione dai sintomi. Un aspetto che vale già la pena notare è che non abbiamo mai avuto bisogno di vaccinazioni ripetute per tenere a bada i quattro noti coronavirus del raffreddore: vaccini per quei coronavirus semplicemente non ne esistono perché non ne abbiamo mai sentito la necessità. Riusciamo a conviverci tranquillamente facendo solo affidamento sulla protezione che deriva da re-infezioni frequenti. Lo stesso invece non si può dire per il Sars-CoV-2: sappiamo infatti che a sei mesi dalla seconda dose la protezione verso l’ospedalizzazione da Covid-19 si riduce di più della metà.

Differenza nella protezione dai vaccini verso Sars-CoV-2.
Questo già ci suggerisce che una futura convivenza con questo virus sarà quasi sicuramente dipendendente dalla nostra capacità di vaccinarci regolarmente. E non solo! Vista la dinamica, dovremmo probabilmente non solo vaccinarci regolarmente ma anche indovinare la finestra giusta per i richiami. Il confronto del caso corrente di Omicron tra Israele (dove le terze dosi sono avvenute in estate) e Regno Unito (dove sono avvenute a novembre e dicembre), ci suggerisce che non è solo importante avere un alto numero di vaccinati ma anche indovinare il tempismo dei richiami. Israele in queste settimane sta vedendo un numero altissimo di contagi e un numero di ospedalizzazioni che non aveva ancora conosciuto a fronte di una percentuale di vaccinati e “boosterati” simile a quella inglese, dove però la terza dose è subentrata dopo.

Israele – casi e ospedalizzazioni. L’ondata Omicron ha portato a un numero altissimo di casi accompagnato al numero di ospedalizzazioni più alto che il paese abbia mai incontrato durante la pandemia. Dati ourworldindata 29/1/2022.
Negli anni a venire è possibile e forse probabile che le vaccinazioni non saranno più di massa ma concentrate soltanto sui soggetti a rischio (per età o per altri fattori) in uno scenario di prevenzione, in sostanza simile a quello dell’influenza. Ma è già abbastanza chiaro che almeno le categorie a rischio non potranno fare affidamento solo ed esclusivamente sulla propria memoria immunitaria come invece fanno per i coronavirus del raffreddore.
Confronti tra soggetti naive
La variante Omicron viene spesso apostrofata come variante “lieve” del virus o, per usare il termine tecnico, “meno virulenta”. E qui forse vale la pena chiarire un paio di termini. La patogenicità di un microorganismo è un fattore qualitativo: ci dice se un microorganismo è o non è in grado di produrre sintomi di malattia in un certo ospite, cioè se il microorganismo è patogenico o no. La virulenza è la misura di questo fenomeno. Quindi non ha senso, tecnicamente, parlare di virus più o meno patogenici così come non ha senso dire che una donna può essere più o meno incinta. O lo è, o non lo è. È un po’ la differenza che incorre in fisica tra calore e temperatura.
La patogenicità di un virus è quindi una caratteristica qualitativa legata a come viene misurata. Un agente può essere patogeno nel topo ma non nell’ uomo, e viceversa. Come il Sars-CoV-2 si comporta nel topo o nel furetto o nel pipistrello ci può interessare per studiarne la biologia ma il problema più stringente o “pandemico” rimane quello legato al rischio sociale, cioè epidemiologico. È l’epidemiologia che in ultima analisi ci dice quanto dobbiamo allarmarci e perché. Un esempio storico importante di questa distinzione che gli scienziati si portano dietro come una cicatrice è quello del Thalidomide, un composto anti-emetico in uso negli anni 50 che era assolutamente innocuo nei roditori ma teratogeno nell’uomo. Fu l’epidemiologia a trovare ed esporre il problema attraverso una minuscola letterina dell’ostetrico australiano McBride su Lancet nel 1961. Quella lettera, riprodotta qui sotto, cambiò in sole 5 frasi la storia della ricerca in una maniera così profonda che è difficile da raccontare, aprendo ad esempio le porte a quella collegialità di condivisione dei dati tra epidemiologi che al momento con il Covid-19 sta facendo una differenza abnorme.
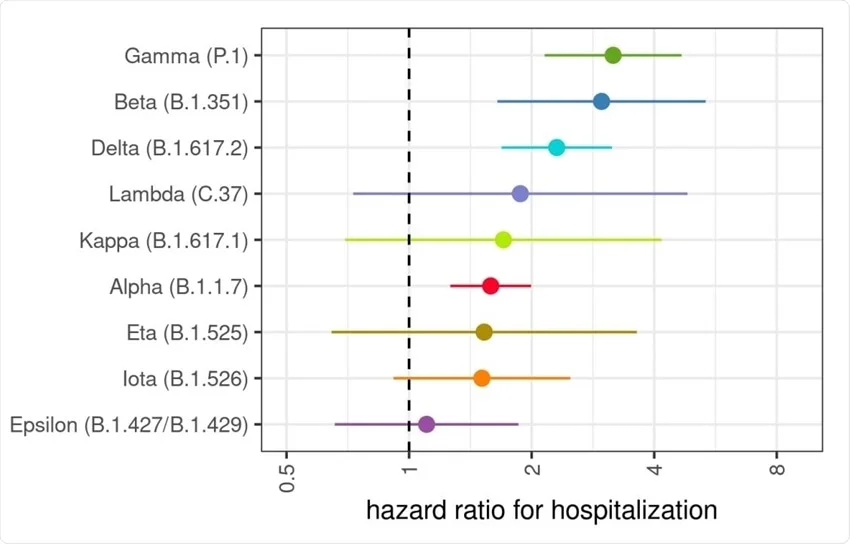
Aperta questa parentesi sulle definizioni del caso e sulle differenze tra analisi di laboratorio e analisi epidemiologiche, torniamo al Covid-19 e vediamo cosa dobbiamo aspettarci dalle sue varianti. Dicevamo che Omicron è spesso definita “lieve”. Questa definizione deriva largamente dal confronto con la variante cronologicamente precedente, Delta. È molto più semplice fare confronti qualitativi e quantitativi tra varianti che circolano contemporaneamente sul territorio perché è l’unico momento in cui tutti i fattori confondenti (numero di vaccinati, pressione sul sistema sanitario, etc.) sono contemporaneamente presenti per l’ una come per l’altra variante e possono quindi essere esclusi (o, più tecnicamente: corretti). Sulla base di questi confronti possiamo quindi tracciare una scheda che ci dica quale sia il rischio legato a ogni variante e quella mappa appare come quella qui sotto (da Paredes et al 2021).
Nella figura sovrastante si vede che quasi ogni variante ha cambiato, aumentandolo, il rischio di ospedalizzazione e il loro rapporto mutuale ci permette di legarle tutte le une alle altre per proprietà transitiva. Al netto di immunità pregressa e vaccini, sappiamo che il rischio associato a Delta è circa 2,5x volte più alto di quello del virus originario (Wuhan). Sappiamo anche che il rischio associato a Omicron nei non-vaccinati è dal 25% (dati UK) al 50% (dati USA) più basso che quello di Delta. La proprietà transitiva ci suggerisce che il rischio di ospedalizzazione legato a Omicron è simile – e forse perfino maggiore – di quello del virus originiario di Wuhan. Questo è corroborato dall’unico studio epidemiologico che finora ha provato a fare questo confronto (Davies et al 2022). Gli autori raggiungono la stessa conclusione.
Il rischio che i non-vaccinati corrono incontrando Omicron non è enormemente più basso di quello che che correvano incontrando Delta e simile se non addiritura superiore a quello che correvano a marzo 2020. La malattia è probabilmente cambiata e interessa forse organi diversi ma il rischio epidemiologico è sempre importante. E questo al netto del fatto che Omicron ha acquisito la capacità di contagiare soggetti con due dosi di vaccino, sui quali Delta incontrava invece molta resistenza. Quindi, dal punto di vista evolutivo, non è corretto dire che il virus ha fatto passi indietro: ha acquisito la capacità di infettare soggetti vaccinati che le altre varianti non riuscivano a scalfire e ha mantenuto proprietà intrinseche simili a quelle del virus ancestrale, quando partì la pandemia (del resto si è anche evoluto dal virus ancestrale, non da Delta!).
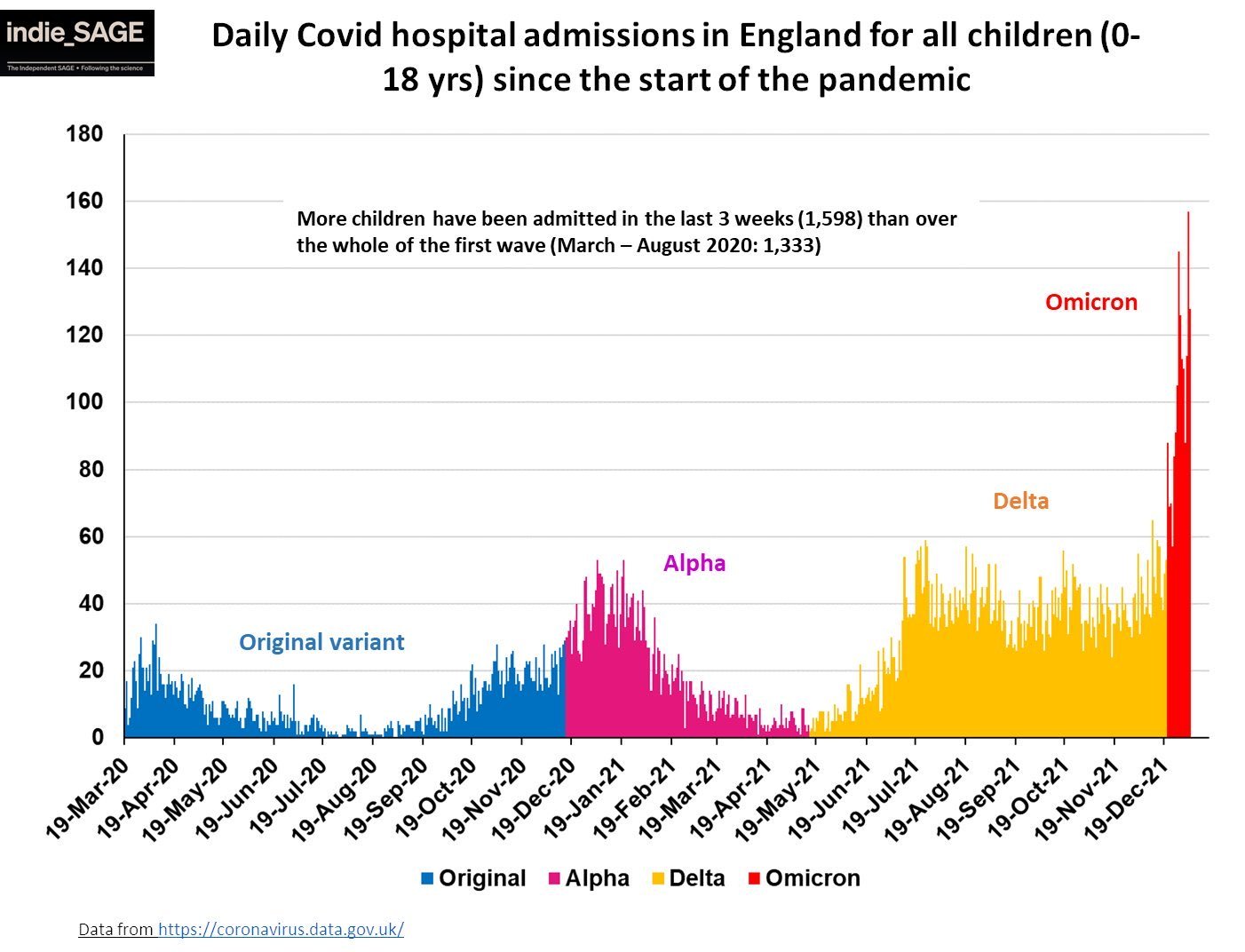
Un altro aspetto che ci dà la possibilità di confrontare varianti tra di loro è guardare a popolazioni non vaccinate o poco vaccinate, come ad esempio i bambini. Questo confronto è fatto non senza complicazioni ma è importante perché, di nuovo, ci mostra qualcosa sull’evoluzione virale. I bambini, soprattutto, nella fascia di età 0-5 anni, non sono ancora vaccinati (lo sono solo a Cuba) e incontrano quindi il virus per la prima volta. La recente ondata Omicron ha portato a un aumento vertiginoso di ospedalizzazioni in quella fascia di età (e nei minorenni in genere) e qualunque sia il motivo di questo incremento, è un qualcosa che i coronavirus del raffreddore non fanno né hanno mai fatto, nemmeno al primo incontro. Importante notare che anche il SARS-CoV-2 ancestrale sembrava molto meno capace non solo di ospedalizzare ma perfino di contagiare quella fascia di età. È complicato fare un confronto diretto perché il virus ancestrale non è mai girato con la voga con cui sta girando questo, quindi non possiamo escludere a priori che anche il virus di Wuhan (o Alpha, o Delta) avrebbero portate a un livello simile di ospedalizzazione pediatrica ma anche solo dalla manifestazione dei sintomi e dei contagi in quella fascia di età è chiaro che qualcosa è cambiato nel “virus che non infettava i bambini”, ricordandoci che non dobbiamo dare per scontato nessuna delle sue proprietà.
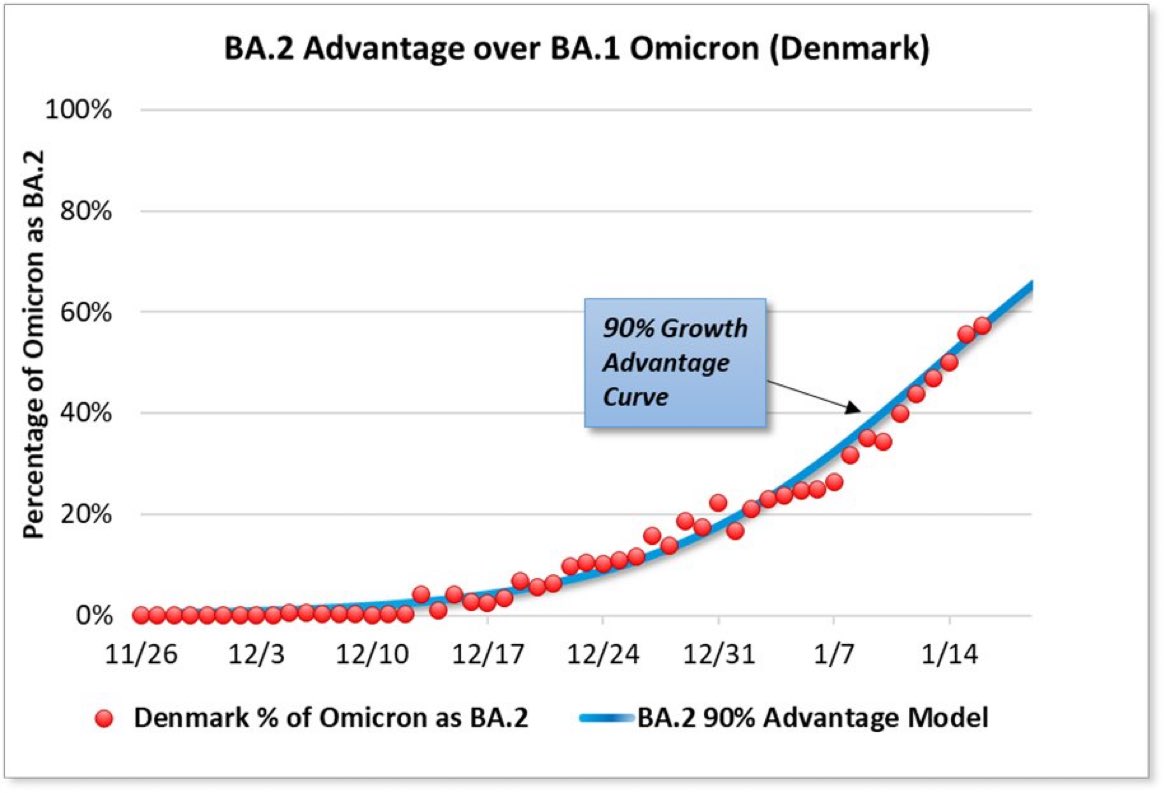
Il comportamento di Omicron nei non vaccinati e nei bambini ci fa concludere, di nuovo, che ci sia qualcosa di intrinsicamente più virulento in Omicron rispetto agli altri virus del raffreddore. Ma quali sono le differenze? La domanda è fondamentale ma complicata soprattutto dalla velocità con cui il virus prende il sopravvento. Prendiamo di nuovo Omicron come esempio: abbiamo appena fatto conoscenza con una sua versione (BA1) che prontamente ne fa capolino un’altra teoricamente molto diversa (BA2) che in alcuni paesi (come la Danimarca) spiazza la prima, tutto nel giro di poche settimane.
Non facciamo in tempo a fare analisi di laboratorio su una versione, che questa quasi diventa già obsoleta. Inoltre Omicron stessa pare avere delle caretteristiche virologiche diverse, con tropismo (cioè bersaglio cellulare/tissutale) diverso e attraverso gruppi recettoriali diversi da Delta. Non tutto ciò che abbiamo scoperto del SARS-CoV-2 si applica a Omicron e anche dal punto di vista virologico sembra quasi un virus diverso.
Da dove arriveranno le prossime varianti?
Chiarita l’importanza che l’evoluzione virale ha giocato finora, occorre quindi domandarci come saranno e da dove arriveranno le prossime varianti. Partiamo da un dato assodato: l’ostacolo principale per un virus è l’immunità pregressa, cioè quella che abbiamo acquisito attraverso vaccini e – sebbene meno significativa – attraverso infezioni precedenti. Vista questa premessa, è chiaro perché nella gara tra varianti vincerà sempre quella che riesce meglio di altre a evadere l’immunità pregressa e, siccome l’immunità più forte è solitamente quella acquisita dall’ultima variante che abbiamo incontrato, ecco spiegato perché le varianti sono tanto più contagiose quanto più sono diverse dalla variante che le ha precedute immediatemente prima. Forse questo è il motivo per cui Delta non si è evoluta da una costola di Alpha né Omicron da una costola di Delta (tra parentesi: in realtà il virus è colmo di sorprese e proprio l’avvento così perentorio di BA2 potrebbe smentire quanto ho appena scritto!). Questo è chiaramente un problema per creare nuovi vaccini perché non è scontato che un vaccino contro Omicron sarebbe poi in grado arrestare la prossima variante. In autunno erano in tanti a chiedere che il vaccino fosse aggiornato a Delta ma col senno di poi sappiamo che non avrebbe fatto nessuna differenza perché Omicron non è una evoluzione di Delta ma una evoluzione di quello che sembra il virus originario.
E come se la questione non fosse ancora abbastanza complicata, va aggiunto che non sappiamo da dove sia emersa Omicron ma che la sua genesi apre un possibile vaso di Pandora. Omicron è stata identificata pubblicamente per la prima volta nel database delle sequenze da Tom Peacock di Imperial College London.
Un paio di giorni dopo, il Sudafrica e l’OMS hanno iniziato a parlarne pubblicamente e solo un paio di settimane dopo è emersa una seconda forma di Omicron molto diversa dalla prima. Questa seconda versione di Omicron, ora nota appunto come BA2, è molto diversa dalla prima, mostrando circa 30 sostituzioni nella proteina Spike. Il virus muta a un ritmo di circa due sostituzioni al mese quindi è impossibile che Omicron abbia acquisito tutte quelle differenze in appena 2 settimane. Cosa significa? Significa che Omicron originaria (BA1) e quella trovata pochi giorni dopo (BA2) sono probabilmente nate assieme: sono sorelle, se non forse gemelle. Cosa potrebbe far emergere due varianti così vicine e così lontane in contemporanea? Una possibilità è un episodio di zoonosi inversa, cioè un episodio in cui il virus passa dall’uomo al serbatoio animali (ad esempio ratti) e in questi si modifica per rendersi più adeguato al nuovo ospite. I ratti, dopo mesi, passano di nuovo il virus all’uomo nelle sue forme modificate. A supporto di questa ipotesi c’è anche il fatto che Omicron stessa abbia acquisito una capacità innata di legare il recettore murino (perdendo, ironicamente, la capacità di infettare il recettore di pipistrello in un esempio da manuale di quello che chiamiamo fitness cost o costo evolutivo – figura sotto da Peacock et al).
Passaggi da animale a uomo possono succedere – come ora dovremmo sapere bene – e sono sempre preoccupanti ma se iniziano a verificarsi con maggiore frequenza cambiano tutte le carte in tavola. Quindi: 1) non sappiamo se Omicron si sia davvero evoluta in un contesto di zoonosi inversa e 2) se anche quello fosse il caso non sappiamo se si sia trattato di una occorrenza unica (il cossiddetto cigno nero) o di un possibile evento ricorrente. Sicuramente il caso va studiato con grande attenzione perché le implicazioni sono gigantesche.
La tempistica delle nuove varianti
Abbiamo in precedenza azzardato un paragone tra le misure di vaccinazione influenzale e quelle che potrebbero diventare le vaccinazioni anti-Covid. A complicare questo scenario semplicistico, purtroppo, rimane la diversa stagionalità dei due virus legata essenzialmente alla differenza nei livelli di trasmissibilità. L’ influenza stagionale ha un valore Rt che è solitamente di poco superiore a 1. Questo vuol dire che è molto più suscettibile ai cambiamenti stagionali nei comportamenti umani (e qui ricordiamoci che non sono tanto i virus a essere stagionali, quanto l’uomo e i suoi comportamenti in relazione al clima, alle esigenze sociali, alle vacanze scolastiche, etc.). Il virus del Covid-19 mostra sì un andamento stagionale ma che, vista l’alta contagiosità, non ne preclude la circolazione d’estate: cambia essenzialmente il profilo degli infetti abbassandone l’età. Sia Delta che Omicron sono emerse molto facilmente nel periodo caldo (aprile in India e dicembre in Sudafrica) e questo ci fa pensare che non è possibile abbassare la guardia verso l’emergere di nuove varianti. Anche dal punto di vista dei tempi non possiamo necessariamente aspettarci una situazione identica a quella influenzale.
Conclusioni
Chi fosse arrivato al fondo di questo scritto aspettandosi risposte e previsioni sarà rimasto deluso ma spero però sia più chiaro per quale motivo la fase in cui stiamo entrando è tutt’altro che limpida e rassicurante. I vaccini hanno rimosso gli aspetti più grossi e “semplici” della minaccia esponendo però quelli più piccoli, insidiosi e soprattutto imprevedibili. È solo grazie ai vaccini se oggi possiamo vivere una vita quasi normale (per quanto a un costo che non è zero) ma il rapporto tra l’uomo e questo coronavirus non ha ancora raggiunto un equlibrio ed è francamente impossibile prevedere che aspetto avrà questo equilibrio né quando arriverà.
Fonte: Scienza in Rete